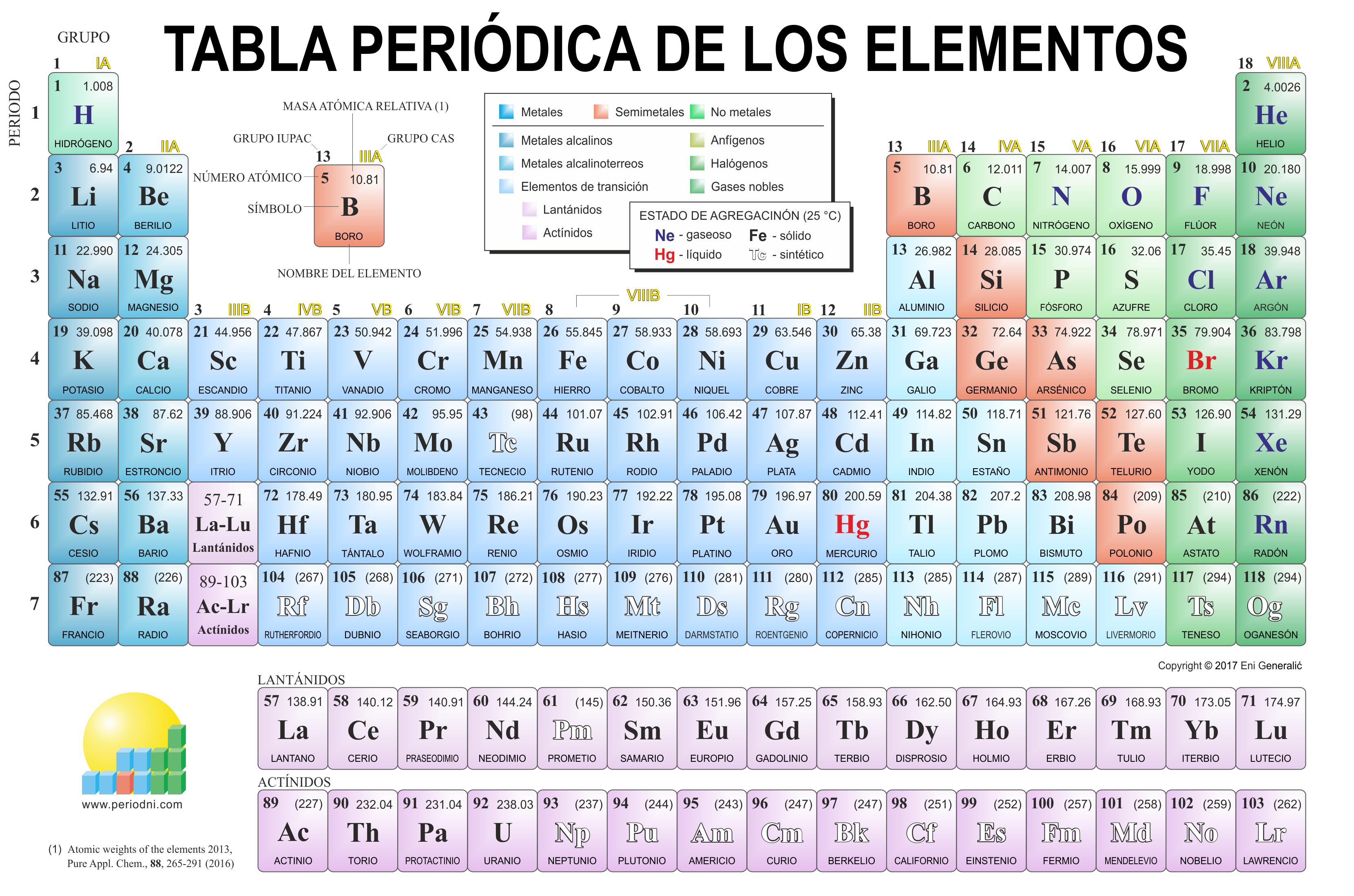
LA TABLA PERIODICA
En este blog usted se podra enterar de todo lo relacionado a la tabla periodica por lo que usted podra estar informado de una manera muy veridica y divertida
INTRODUCCION:La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones),por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo xvii, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo xviii se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo xix, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo xix, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc. Durante el siglo xx, la investigación en los procesos radioactivos llevó al descubrimiento en cascada de una serie de elementos pesados (casi siempre sustancias artificiales sintetizadas en laboratorio, con periodos de vida estable muy cortos), hasta alcanzar la cifra de 118 elementos con denominación oficialmente aceptados por la IUPAC en noviembre de 2016.
 Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Más tarde, Mendeléyev añadió las fórmulas correspondientes a los óxidos e hidruros de cada sección. A finales del siglo XIX, la tabla periódica comenzó a incluir el grupo cero (con los denominados gases nobles), llamado de esa forma por la ausencia de actividad química (de valencia cero).

/Seaborgium_Tile-56a12a485f9b58b7d0bcaa42.png)








INTRODUCCION:La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones),por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo xvii, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo xviii se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo xix, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo xix, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc. Durante el siglo xx, la investigación en los procesos radioactivos llevó al descubrimiento en cascada de una serie de elementos pesados (casi siempre sustancias artificiales sintetizadas en laboratorio, con periodos de vida estable muy cortos), hasta alcanzar la cifra de 118 elementos con denominación oficialmente aceptados por la IUPAC en noviembre de 2016.
Desde los comienzos de la ciencia se intenta comprender el por qué y el cómo de la materia y los elementos que conforman nuestro sistema. Gracias a las diferentes experiencias de los científicos cada vez se ha podido descomponer aún más la materia para analizarla palmo a palmo, llegando finalmente a averiguar que es mucho más compleja que lo que a simple vista parece.
A partir del siglo XIX los científicos tuvieron la necesidad de establecer un orden en los elementos descubiertos. La forma en la que decidieron hacerlo, fue partiendo de sus masas atómicas y agrupando aquellos que se asemejaran; sin embargo esta tarea no era tan sencilla ya que era difícil reflejar en un cuadro ordenado las similitudes y diferencias entre unos y otros.
El químico Döbereiner fue quien en 1817 presentó un informe donde se plasmaba la relación que existía entre la masa y las propiedades de los diferentes elementos. Así formó los grupos de elementos semejantes, como lo son las triadas, como la que forman cloro, bromo y yodo, donde la masa de uno de ellos se ubica en medio de los otros dos. Partiendo de esa investigación, en 1850, se llegaron a armar alrededor de 20 triadas.
Posteriormente, Chancourtois y Newlands descubrieron la Ley de las octavas que permitió mejorar no sólo la distribución de los elementos en la tabla, sino las relaciones en ella plasmadas. Dicha Ley observa que las propiedades químicas se repiten sucesivamente cada ocho elementos. Sin embargo algunos elementos rompían con ella, por lo que no era suficiente para establecer una coherencia clara en la tabla.
Cuando en 1869 Meyer comprobó que el volumen atómico de los elementos presentaba una cierta periodicidad; se supo que ciertos elementos que tenían un volumen similar a aquellos elementos que se les parecen en composición.
 Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.Más tarde, Mendeléyev añadió las fórmulas correspondientes a los óxidos e hidruros de cada sección. A finales del siglo XIX, la tabla periódica comenzó a incluir el grupo cero (con los denominados gases nobles), llamado de esa forma por la ausencia de actividad química (de valencia cero).
El químico francés Antoine Lavoisier (1743-1794) elaboró una lista de 33 elementos conocidos hasta ese momento. Estos eran representaciones en una sola dimensión mientras que los actuales se presentan en dos o tres dimensiones con filas y columnas ordenadas que permiten ubicar a todos los elementos conocidos y los que aún se descubrirán.
-Johann Wolfgang Dobereiner (1780-1849) descubrió que los elementos con propiedades semejantes pueden estudiarse agrupándolos en ternas o triadas, en las que el elemento central tiene una masa atómica aproximadamente igual a la media arimética de las masas atómicas de los otros dos.
-Alexandre-Émile Beguyer de Chancourtois (1820-1886) y John Alexandre Reian Newlands (1837-1898) publicaron que si se clasificaran los elementos según el orden creciente de sus masas atómicas (dejando el hidrógeno), después de colocar 7 elementos, en el octavo, se repetían las propiedades del primero. Debido a las semejanzas de la distribución con la escala musical, se la llamó Ley de las octavas de Newlands.
-El químico ruso Dimitri Ivanovich Mendeleiev (1834-1907), dispuso los elementos conocidos (63) en líneas por orden creciente de la masa atómica, de manera que los que tenían igual similaridad química (valencia) se hallaban ubicados en una misma hilera vertical. Estos elementos mostraban un gran parecido en sus propiedades. Esta organización la denominó Mendeléiev ley Periódica de los Elementos. En ésta, hubo las casillas
suficientes para los nuevos elementos a descubrir en el futuro.
Julius Lothar Meyer (1830- 1895) construyó un grafico de periodicidad del volumen atómico versus la masa atómica, que indicó que las relaciones entre propiedades son periódicas con
respecto a la masa atómica.
-1871 Dimitri Ivanovich Mendeleiev diseñó un cuadro compuesto por 7 Filas (períodos) y ocho columnas. Al conjunto de elementos en la Fila vertical lo llamó familia o grupo por tener propiedades semejantes. A diferencia de la tabla de Newlands, la de Mendeleiev relaciona familias. Mendeleiev prevé las propiedades químicas y físicas de tres elementos que años después serían descubiertos como Escandio , Galio y Germanio .
-Marie Curie, (1867 -1934) fue una física y química polaca. Pionera en el campo de la radioactividad, primera persona en conseguir dos premios Nobel. Descubrió los elementos químicos radio y Polonio en 1898 en apoyo con su esposo Pierre Curie.
-Los trabajos de Henry Moseley (1887-1915), relativos al estudio de los espectros de rayos X de los elementos permitieron conocer el respectivo número atómico . Se Comprobó que al ordenar los elementos según el orden creciente del número atómico las parejas que resultaban alteradas en la ordenación de Mendeléiev se hallaban correctamente dispuestas. De este modo se establece el sistema periódico actual
-1936 Se descubre el primer elemento artificial, de número atómico 43, el tecnecio , mediante el método de Fermi (bombardear un átomo con neutrones acelerados con un ciclotrón).
-1950 El grupo dirigido por Glenn T. Seaborg (1912-1999), en EE.UU., descubre los elementos 94 al 100.
-1955-1974 Durante la Guerra Fría, rusos y norteamericanos compiten para sintetizar los elementos hasta el 106, se descubren nuevos elementos, mediante la técnica de fusión en frío
-1996 Durante la Guerra Fría, rusos y norteamericanos compiten para sintetizar los elementos hasta el 106, se descubren nuevos elementos, mediante la técnica de fusión en frío
-1997 Se nombran los siguientes elementos:
-Johann Wolfgang Dobereiner (1780-1849) descubrió que los elementos con propiedades semejantes pueden estudiarse agrupándolos en ternas o triadas, en las que el elemento central tiene una masa atómica aproximadamente igual a la media arimética de las masas atómicas de los otros dos.
-Alexandre-Émile Beguyer de Chancourtois (1820-1886) y John Alexandre Reian Newlands (1837-1898) publicaron que si se clasificaran los elementos según el orden creciente de sus masas atómicas (dejando el hidrógeno), después de colocar 7 elementos, en el octavo, se repetían las propiedades del primero. Debido a las semejanzas de la distribución con la escala musical, se la llamó Ley de las octavas de Newlands.
-El químico ruso Dimitri Ivanovich Mendeleiev (1834-1907), dispuso los elementos conocidos (63) en líneas por orden creciente de la masa atómica, de manera que los que tenían igual similaridad química (valencia) se hallaban ubicados en una misma hilera vertical. Estos elementos mostraban un gran parecido en sus propiedades. Esta organización la denominó Mendeléiev ley Periódica de los Elementos. En ésta, hubo las casillas
suficientes para los nuevos elementos a descubrir en el futuro.
Julius Lothar Meyer (1830- 1895) construyó un grafico de periodicidad del volumen atómico versus la masa atómica, que indicó que las relaciones entre propiedades son periódicas con
respecto a la masa atómica.
-1871 Dimitri Ivanovich Mendeleiev diseñó un cuadro compuesto por 7 Filas (períodos) y ocho columnas. Al conjunto de elementos en la Fila vertical lo llamó familia o grupo por tener propiedades semejantes. A diferencia de la tabla de Newlands, la de Mendeleiev relaciona familias. Mendeleiev prevé las propiedades químicas y físicas de tres elementos que años después serían descubiertos como Escandio , Galio y Germanio .
-Marie Curie, (1867 -1934) fue una física y química polaca. Pionera en el campo de la radioactividad, primera persona en conseguir dos premios Nobel. Descubrió los elementos químicos radio y Polonio en 1898 en apoyo con su esposo Pierre Curie.
-Los trabajos de Henry Moseley (1887-1915), relativos al estudio de los espectros de rayos X de los elementos permitieron conocer el respectivo número atómico . Se Comprobó que al ordenar los elementos según el orden creciente del número atómico las parejas que resultaban alteradas en la ordenación de Mendeléiev se hallaban correctamente dispuestas. De este modo se establece el sistema periódico actual
-1936 Se descubre el primer elemento artificial, de número atómico 43, el tecnecio , mediante el método de Fermi (bombardear un átomo con neutrones acelerados con un ciclotrón).
-1950 El grupo dirigido por Glenn T. Seaborg (1912-1999), en EE.UU., descubre los elementos 94 al 100.
-1955-1974 Durante la Guerra Fría, rusos y norteamericanos compiten para sintetizar los elementos hasta el 106, se descubren nuevos elementos, mediante la técnica de fusión en frío
-1996 Durante la Guerra Fría, rusos y norteamericanos compiten para sintetizar los elementos hasta el 106, se descubren nuevos elementos, mediante la técnica de fusión en frío
-1997 Se nombran los siguientes elementos:
Rutherfordium (Rf)
Dubnium (Db)
Dubnium (Db)
Seaborgium (Sg)
/Seaborgium_Tile-56a12a485f9b58b7d0bcaa42.png)
Bohrium (Bh)

Hassium (Hs)
Meitnerium (Mt)

Elementos químicos en la tabla periódica de los elementos
Los elementos químicos se encuentran clasificados en la tabla periódica de los elementos.
A continuación se detallan los elementos conocidos, ordenados por su número atómico.
| Número atómico | Nombre | Símbolo | Periodo, Grupo | peso atómico (uma) | Densidad (g/cm³) a 20°C | Punto de fusión (°C) | Punto de ebullición (°C) | Año de su descubrimiento | Persona que lo descubrió |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Hidrógeno | H | 1, 1 | 1.00794(7)234 | 0.084 g/l | -259.1 | -252.69 | 1766 | T. Von Hohenheim (Paracelso) |
| 2 | Helio | He | 1, 18 | 4.002602(2)24 | 0.17 g/l | -272.2 | -268.9 | 1895 | Ramsay y Cleve |
| 3 | Litio | Li | 2, 1 | 6.941(2)2345 | 0.53 | 180.5 | 1317 | 1817 | Arfwedson |
| 4 | Berilio | Be | 2, 2 | 9.012182(3) | 1.85 | 1278 | 2970 | 1797 | Vauquelin |
| 5 | Boro | B | 2, 13 | 10.811(7)234 | 2.46 | 2300 | 2550 | 1808 | Davy y Gay-Lussac |
| 6 | Carbono | C | 2, 14 | 12.0107(8)24 | 3.51 | 3550 | 4827 | Prehistoria | Desconocido |
| 7 | Nitrógeno | N | 2, 15 | 14.0067(2)24 | 1.17 g/l | -209.9 | -195.8 | 1772 | Rutherford |
| 8 | Oxígeno | O | 2, 16 | 15.9994(3)24 | 1.33 g/l | -218.4 | -182.9 | 1774 | Priestly y Scheele |
| 9 | Flúor | F | 2, 17 | 18.9984032(5) | 1.58 g/l | -219.6 | -188.1 | 1886 | Moissan |
| 10 | Neón | Ne | 2, 18 | 20.1797(6)23 | 0.84 g/l | -248.7 | -246.1 | 1898 | Ramsay y Travers |
| 11 | Sodio | Na | 3, 1 | 22.98976928(2) | 0.97 | 97.8 | 892 | 1807 | Davy |
| 12 | Magnesio | Mg | 3, 2 | 24.3050(6) | 1.74 | 648.8 | 1107 | 1755 | Black |
| 13 | Aluminio | Al | 3, 13 | 26.9815386(8) | 2.70 | 660.5 | 2467 | 1825 | Oersted |
| 14 | Silicio | Si | 3, 14 | 28.0855(3)4 | 2.33 | 1410 | 2355 | 1824 | Berzelius |
| 15 | Fósforo | P | 3, 15 | 30.973762(2) | 1.82 | 44 (P4) | 280 (P4) | 1669 | Brand |
| 16 | Azufre | S | 3, 16 | 32.065(5)24 | 2.06 | 113 | 444.7 | Prehistoria | Desconocido |
| 17 | Cloro | Cl | 3, 17 | 35.453(2)234 | 2.95 g/l | -34.6 | -101 | 1774 | Scheele |
| 18 | Argón | Ar | 3, 18 | 39.948(1)24 | 1.66 g/l | -189.4 | -185.9 | 1894 | Ramsay y Rayleigh |
| 19 | Potasio | K | 4, 1 | 39.0983(1) | 0.86 | 63.7 | 774 | 1807 | Davy |
| 20 | Calcio | Ca | 4, 2 | 40.078(4)2 | 1.54 | 839 | 1487 | 1808 | Davy |
| 21 | Escandio | Sc | 4, 3 | 44.955912(6) | 2.99 | 1539 | 2832 | 1879 | Nilson |
| 22 | Titanio | Ti | 4, 4 | 47.867(1) | 4.51 | 1660 | 3260 | 1791 | Gregor y Klaproth |
| 23 | Vanadio | V | 4, 5 | 50.9415(1) | 6.09 | 1890 | 3380 | 1801 | del Río |
| 24 | Cromo | Cr | 4, 6 | 51.9961(6) | 7.14 | 1857 | 2482 | 1797 | Vauquelin |
| 25 | Manganeso | Mn | 4, 7 | 54.938045(5) | 7.44 | 1244 | 2097 | 1774 | Gahn |
| 26 | Hierro | Fe | 4, 8 | 55.845(2) | 7.87 | 1535 | 2750 | Prehistoria | Desconocido |
| 27 | Cobalto | Co | 4, 9 | 58.933200(9) | 8.89 | 1495 | 2870 | 1735 | Brandt |
| 28 | Níquel | Ni | 4, 10 | 58.6934(2) | 8.91 | 1453 | 2732 | 1751 | Cronstedt |
| 29 | Cobre | Cu | 4, 11 | 63.546(3)4 | 8.92 | 1083.5 | 2595 | Prehistoria | Desconocido |
| 30 | Zinc | Zn | 4, 12 | 65.409(4) | 7.14 | 419.6 | 907 | Prehistoria | Paracelso |
| 31 | Galio | Ga | 4, 13 | 69.723(1) | 5.91 | 29.8 | 2403 | 1875 | Lecoq de Boisbaudran |
| 32 | Germanio | Ge | 4, 14 | 72.64(1) | 5.32 | 937.4 | 2830 | 1886 | Winkler |
| 33 | Arsénico | As | 4, 15 | 74.92160(2) | 5.72 | 613 | 613 (sublimación) | ca. 1250 | Albertus Magnus |
| 34 | Selenio | Se | 4, 16 | 78.96(3)4 | 4.82 | 217 | 685 | 1817 | Berzelius |
| 35 | Bromo | Br | 4, 17 | 79.904(1) | 3.14 | -7.3 | 58.8 | 1826 | Balard |
| 36 | Kriptón | Kr | 4, 18 | 83.798(2)23 | 3.48 g/l | -156.6 | -152.3 | 1898 | Ramsay y Travers |
| 37 | Rubidio | Rb | 5, 1 | 85.4678(3)2 | 1.53 | 39 | 688 | 1861 | Bunsen y Kirchhoff |
| 38 | Estroncio | Sr | 5, 2 | 87.62(1)24 | 2.63 | 769 | 1384 | 1790 | Crawford |
| 39 | Itrio | Y | 5, 3 | 88.90585(2) | 4.47 | 1523 | 3337 | 1794 | Gadolin |
| 40 | Zirconio | Zr | 5, 4 | 91.224(2)2 | 6.51 | 1852 | 4377 | 1789 | Klaproth |
| 41 | Niobio | Nb | 5, 5 | 92.906 38(2) | 8.58 | 2468 | 4927 | 1801 | Hatchett |
| 42 | Molibdeno | Mo | 5, 6 | 95.94(2)2 | 10.28 | 2617 | 5560 | 1778 | Scheele |
| 43 | Tecnecio | Tc | 5, 7 | [98.9063]6 | 11.49 | 2172 | 5030 | 1937 | Perrier y Segrè |
| 44 | Rutenio | Ru | 5, 8 | 101.07(2)2 | 12.45 | 2310 | 3900 | 1844 | Klaus |
| 45 | Rodio | Rh | 5, 9 | 102.90550(2) | 12.41 | 1966 | 3727 | 1803 | Wollaston |
| 46 | Paladio | Pd | 5, 10 | 106.42(1)2 | 12.02 | 1552 | 3140 | 1803 | Wollaston |
| 47 | Plata | Ag | 5, 11 | 107.8682(2)2 | 10.49 | 961.9 | 2212 | Prehistoria | Desconocido |
| 48 | Cadmio | Cd | 5, 12 | 112.411(8)2 | 8.64 | 321 | 765 | 1817 | Strohmeyer y Hermann |
| 49 | Indio | In | 5, 13 | 114.818(3) | 7.31 | 156.2 | 2080 | 1863 | Reich y Richter |
| 50 | Estaño | Sn | 5, 14 | 118.710(7)2 | 7.29 | 232 | 2270 | Prehistoria | Desconocido |
| 51 | Antimonio | Sb | 5, 15 | 121.760(1)2 | 6.69 | 630.7 | 1750 | Prehistoria | Desconocido |
| 52 | Teluro | Te | 5, 16 | 127.60(3)2 | 6.25 | 449.6 | 990 | 1782 | von Reichenstein |
| 53 | Yodo | I | 5, 17 | 126.90447(3) | 4.94 | 113.5 | 184.4 | 1811 | Courtois |
| 54 | Xenón | Xe | 5, 18 | 131.293(6)23 | 4.49 g/l | -111.9 | -107 | 1898 | Ramsay y Travers |
| 55 | Cesio | Cs | 6, 1 | 132.9054519(2) | 1.90 | 28.4 | 690 | 1860 | Kirchhoff y Bunsen |
| 56 | Bario | Ba | 6, 2 | 137.327(7) | 3.65 | 725 | 1640 | 1808 | Davy |
| 57 | Lantano | La | 6 | 138.90547(7)2 | 6.16 | 920 | 3454 | 1839 | Mosander |
| 58 | Cerio | Ce | 6 | 140.116(1)2 | 6.77 | 798 | 3257 | 1803 | W. Hisinger y Berzelius |
| 59 | Praseodimio | Pr | 6 | 140.90765(2) | 6.48 | 931 | 3212 | 1895 | von Welsbach |
| 60 | Neodimio | Nd | 6 | 144.242(3)2 | 7.00 | 1010 | 3127 | 1895 | von Welsbach |
| 61 | Prometio | Pm | 6 | [146.9151]6 | 7.22 | 1080 | 2730 | 1945 | Marinsky y Glendenin |
| 62 | Samario | Sm | 6 | 150.36(2)2 | 7.54 | 1072 | 1778 | 1879 | Lecoq de Boisbaudran |
| 63 | Europio | Eu | 6 | 151.964(1)2 | 5.25 | 822 | 1597 | 1901 | Demarçay |
| 64 | Gadolinio | Gd | 6 | 157.25(3)2 | 7.89 | 1311 | 3233 | 1880 | de Marignac |
| 65 | Terbio | Tb | 6 | 158.92535(2) | 8.25 | 1360 | 3041 | 1843 | Mosander |
| 66 | Disprosio | Dy | 6 | 162.500(1)2 | 8.56 | 1409 | 2335 | 1886 | Lecoq de Boisbaudran |
| 67 | Holmio | Ho | 6 | 164.93032(2) | 8.78 | 1470 | 2720 | 1878 | Soret |
| 68 | Erbio | Er | 6 | 167.259(3)2 | 9.05 | 1522 | 2510 | 1842 | Mosander |
| 69 | Tulio | Tm | 6 | 168.93421(2) | 9.32 | 1545 | 1727 | 1879 | Cleve |
| 70 | Iterbio | Yb | 6 | 173.04(3)2 | 6.97 | 824 | 1193 | 1878 | de Marignac |
| 71 | Lutecio | Lu | 6, 3 | 174.967(1)2 | 9.84 | 1656 | 3315 | 1907 | Urbain |
| 72 | Hafnio | Hf | 6, 4 | 178.49(2) | 13.31 | 2150 | 5400 | 1923 | Coster y de Hevesy |
| 73 | Tantalio | Ta | 6, 5 | 180.9479(1) | 16.68 | 2996 | 5425 | 1802 | Ekeberg |
| 74 | Wolframio | W | 6, 6 | 183.84(1) | 19.26 | 3407 | 5927 | 1783 | Elhuyar |
| 75 | Renio | Re | 6, 7 | 186.207(1) | 21.03 | 3180 | 5627 | 1925 | Noddack, Tacke y Berg |
| 76 | Osmio | Os | 6, 8 | 190.23(3)2 | 22.61 | 3045 | 5027 | 1803 | Tennant |
| 77 | Iridio | Ir | 6, 9 | 192.217(3) | 22.56 | 2410 | 4130 | 1803 | Tennant |
| 78 | Platino | Pt | 6, 10 | 195.084(9) | 21.45 | 1772 | 3827 | 1735 | de Ulloa |
| 79 | Oro | Au | 6, 11 | 196.966569(4) | 19.32 | 1064.4 | 2940 | Prehistoria | Desconocido |
| 80 | Mercurio | Hg | 6, 12 | 200.59(2) | 13.55 | -38.9 | 356.6 | Prehistoria | Desconocido |
| 81 | Talio | Tl | 6, 13 | 204.3833(2) | 11.85 | 303.6 | 1457 | 1861 | Crookes |
| 82 | Plomo | Pb | 6, 14 | 207.2(1)24 | 11.34 | 327.5 | 1740 | Prehistoria | Desconocido |
| 83 | Bismuto | Bi | 6, 15 | 208.98040(1) | 9.80 | 271.4 | 1560 | 1753 | Geoffroy |
| 84 | Polonio | Po | 6, 16 | [208.9824]6 | 9.20 | 254 | 962 | 1898 | Marie y Pierre Curie |
| 85 | Astato | At | 6, 17 | [209.9871]6 | 302 | 337 | 1940 | Corson y MacKenzie | |
| 86 | Radón | Rn | 6, 18 | [222.0176]6 | 9.23 g/l | -71 | -61.8 | 1900 | Dorn |
| 87 | Francio | Fr | 7, 1 | [223.0197]6 | 27 | 677 | 1939 | Perey | |
| 88 | Radio | Ra | 7, 2 | [226.0254]6 | 5.50 | 700 | 1140 | 1898 | Marie y Pierre Curie |
| 89 | Actinio | Ac | 7 | [227.0278]6 | 10.07 | 1047 | 3197 | 1899 | Debierne |
| 90 | Torio | Th | 7 | 232.03806(2)6 2 | 11.72 | 1750 | 4787 | 1829 | Berzelius |
| 91 | Protactinio | Pa | 7 | 231.03588(2)6 | 15.37 | 1554 | 4030 | 1917 | Hahn y Meitner |
| 92 | Uranio | U | 7 | 238.02891(3)6 23 | 18.97 | 1132.4 | 3818 | 1789 | Klaproth |
| 93 | Neptunio | Np | 7 | [237.0482]6 | 20.48 | 640 | 3902 | 1940 | McMillan y Abelson |
| 94 | Plutonio | Pu | 7 | [244.0642]6 | 19.74 | 641 | 3327 | 1940 | Seaborg |
| 95 | Americio | Am | 7 | [243.0614]6 | 13.67 | 994 | 2607 | 1944 | Seaborg |
| 96 | Curio | Cm | 7 | [247.0703]6 | 13.51 | 1340 | 1944 | Seaborg | |
| 97 | Berkelio | Bk | 7 | [247.0703]6 | 13.25 | 986 | 1949 | Seaborg | |
| 98 | Californio | Cf | 7 | [251.0796]6 | 15.1 | 900 | 1950 | Seaborg | |
| 99 | Einstenio | Es | 7 | [252.0829]6 | 860 | 1952 | Seaborg | ||
| 100 | Fermio | Fm | 7 | [257.0951]6 | 1952 | Seaborg | |||
| 101 | Mendelevio | Md | 7 | [258.0986]6 | 1955 | Seaborg | |||
| 102 | Nobelio | No | 7 | [259.1009]6 | 1958 | Seaborg | |||
| 103 | Laurencio | Lr | 7, 3 | [260.1053]6 | 1961 | Ghiorso | |||
| 104 | Rutherfordio | Rf | 7, 4 | [261.1087]6 | 1964/69 | Flerov | |||
| 105 | Dubnio | Db | 7, 5 | [262.1138]6 | 1967/70 | Flerov | |||
| 106 | Seaborgio | Sg | 7, 6 | [263.1182]6 | 1974 | Flerov | |||
| 107 | Bohrio | Bh | 7, 7 | [262.1229]6 | 1976 | Oganessian | |||
| 108 | Hassio | Hs | 7, 8 | [265]6 | 1984 | GSI (*) | |||
| 109 | Meitnerio | Mt | 7, 9 | [266]6 | 1982 | GSI | |||
| 110 | Darmstadtio | Ds | 7, 10 | [269]6 | 1994 | GSI | |||
| 111 | Roentgenio | Rg | 7, 11 | [272]6 | 1994 | GSI | |||
| 112 | Copernicio | Cn | 7, 12 | [285]6 | 1996 | GSI | |||
| 113 | Nihonio | Nh | 7, 13 | [284]6 | 2004 | JINR (*), LLNL (*) | |||
| 114 | Flerovio | Fl | 7, 14 | [289]6 | 1999 | JINR | |||
| 115 | Moscovio | Mc | 7, 15 | [288]6 | 2004 | JINR, LLNL | |||
| 116 | Livermorio | Lv | 7, 16 | [290]6 | 2006 | JINR, LLNL(**) | |||
| 117 | Tenesino | Ts | 7, 17 | 6 | 2009-2010 | JINR | |||
| 118 | Oganesón | Og | 7, 18 | [294]6 | 2006 | JINR, LLNL |

Alcalino
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Metales alcalinos |
Los metales alcalinos o simplemente alcalinos (del árabe, alqali) son los seis elementos situados en el grupo I (1) de la tabla periódica1 (excepto el hidrógeno, que es un gas).
El grupo de los metales alcalinos está formados por los elementos que se sitúan en la primera columna (grupo) de la tabla periódica o sistema periódico, lo componen los elementos químicos litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio(Cs), francio (Fr). Pertenecen a la serie de elementos s, esto significa que los metales alcalinos tienen su electrón más externo en un orbital s, cada uno tiene solo un electrón en su nivel energético más externo (s), con buena tendencia a perderlo (esto es debido a que tienen poca afinidad electrónica, y baja energía de ionización), con lo que forman un ion monovalente, M+. Esta configuración electrónica compartida da como resultado que tengan propiedades características muy similares. De hecho, los metales alcalinos proporcionan el mejor ejemplo de tendencias de grupo en propiedades en la tabla periódica, con elementos que exhiben un comportamiento homólogo bien caracterizado.
Presentan densidades muy bajas y son buenos conductores de calor y la electricidad; reaccionan de inmediato con el agua, oxígeno y otras sustancias químicas, y nunca se les encuentra como elementos libres (no combinados) en la naturaleza.
Los metales alcalinos son todos brillantes, blandos y muy reactivos a temperatura y presión normal. Son maleables y se pueden cortar fácilmente debido a su escasa dureza, exponiendo una superficie brillante que se empaña rápidamente en el aire debido a la oxidación por la humedad atmosférica y el oxígeno (y en el caso de litio, por la presencia de nitrógeno también). Debido a su alta reactividad, deben ser almacenados en aceite para evitar la reacción con el aire, naturalmente se encuentran sólo como sales, nunca como los elementos libres. El cesio, quinto metal alcalino, es el más reactivo de todos los metales. En la nomenclatura moderna IUPAC, los metales alcalinos comprenden los elementos del grupo 1, salvo el hidrógeno (H), que nominalmente es un elemento del grupo 1, pero no se considera un metal alcalino, pero como el hidrógeno no tiene un lugar asignado entre los grupos del sistema periódico se le suele asignar el grupo 1. Todos los metales alcalinos reaccionan con el agua, los metales alcalinos más pesados más vigorosamente que los más ligeros.
Los compuestos típicos de los metales alcalinos son solubles en agua y están presentes en el agua de mar y en depósitos salinos. Como estos metales reaccionan rápidamente con el oxígeno, se venden en recipientes al vacío, pero por lo general se almacenan bajo aceite mineral queroseno. La configuración electrónica del grupo 1 o los metales alcalinos es ns¹. Por ello se dice que se encuentran en la zona "s" de la tabla periódica.
Todos los metales alcalinos descubiertos se encuentran en la naturaleza: en orden de abundancia, el sodio es el más abundante, seguido por el potasio, litio, rubidio, cesio y finalmente el francio, que es muy raro debido a su alta radioactividad y corta vida media; en la naturaleza el francio se encuentra como subproducto en la descomposición natural del actinio.
Se han realizado experimentos para intentar la síntesis del ununennio (119-Uue), que probablemente sea el próximo miembro del grupo, pero todos han sido infructuosos. Sin embargo, el 119 (ununennio) es posible que no se le pueda incluir en el grupo, lo que sí es cierto es que se prevé que tendrá una gran influencia en las propiedades químicas de los elementos superpesados; Incluso si se acepta como metal alcalino, se prevé que tenga diferencias en las propiedades físicas y químicas de sus homólogos más ligeros.
Alcalinotérreo
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Metales alcalinotérreos |
Los metales alcalinotérreos son un grupo de elementos que se encuentran situados en el grupo 2 de la tabla periódica y son los siguientes: berilio (Be), magnesio (Mg), calcio (Ca), estroncio(Sr), bario (Ba) y radio (Ra). Este último no siempre se considera, pues tiene un tiempo de vida media corta.
El nombre «alcalinotérreos» proviene del nombre que recibían sus óxidos, «tierras», que tienen propiedades básicas (alcalinas). Poseen una electronegatividad ≤ 1,57 según la escala de Pauling.
Características: son más duros que los metales alcalinos, tienen brillo y son buenos conductores eléctricos; menos reactivos que los alcalinos, buenos agentes reductores y forman compuestos iónicos. Todos ellos tienen dos (2) electrones en su capa más externa (electrones de Valencia).
Propiedades
- Tienen una configuración electrónica ns^2 .
- Tienen baja energía de ionización, aunque mayor que los alcalinos del mismo período, tanto menor si se desciende en el grupo.
- A excepción del berilio, forman compuestos claramente iónicos.
- Son metales de baja densidad, coloreados y blandos.
- La solubilidad de sus compuestos es bastante menor que sus correspondientes alcalinos.
- Todos tienen sólo dos electrones en su nivel energético más externo, con tendencia a perderlos, por su lado con lo que forman un ion positivo.
- Todos tienen como valencia +2
Reacciones
- Reaccionan con facilidad con halógenos para formar sales iónicas.
M + X2 —> MX2
Elementos del grupo 3

Un elemento del grupo 3 es un elemento situado dentro de la tabla periódica en el grupo 3. Los átomos de estos elementos tienen gran tendencia a oxidarse y son muy reactivos, predominando el estado de oxidación +3. Presentan propiedades muy similares al aluminio. Dan lugar a iones incoloros.
| Grupo -> | 3 |
| Periodo | |
| 4 | 21 Sc |
| 5 | 39 Y |
| 6 | 57 La |
| 7 | 89 A |
Elementos
Como otros grupos de elementos del bloque d, el grupo 3 debería contener 4 elementos, pero no hay un consenso sobre cuáles debería comprender.
- Aceptados:
- Discutidos:
- Elementos del grupo 3
Propiedades
- Tienen brillo
- Son reactivos
- Conducen la dass
Elementos del grupo 4
El grupo 4 de la tabla periódica lo comprenden los elementos titanio (Ti), circonio (Zr) y hafnio (Hf), así como el elemento rutherfordio(Rf), aunque no se suele tener en cuenta al referirse al grupo 4 pues se trata de un elemento sintético y radiactivo. "Grupo 4" es el nombre recomendado por la IUPAC; el antiguo nombre europeo es "grupo IVA", mientras que el nombre antiguo estadounidense es "grupo IVB". El nombre de la IUPAC no debe confundirse con los antiguos, dados con números romanos. Estos metales son bastante reactivos (sobre todo cuando están en forma de esponja porosa, de gran superficie específica, son pirofóricos; esto es, al exponerse a la acción del aire se vuelven rojos e inflaman espontáneamente). Al estar compactos son pasivos, casi inatacables por cualquier agente atmosférico.
- Elementos del grupo 4
Véase también
- Grupo de la tabla periódica
Elementos del grupo 5
Un elemento del grupo 5 es un elemento situado dentro de la tabla periódica en el grupo 5 que comprende los elementos:
| Grupo | 5 |
| Periodo | |
| 4 | 23 V |
| 5 | 41 Nb |
| 6 | 73 Ta |
| 7 | 105 Db |
Estos elementos tienen en sus niveles electrónicos más externos 5 electrones. El dubnio no se encuentra en la naturaleza y se produce en el laboratorio, por lo que al hablar de las propiedades de los elementos del grupo 5, se suele obviar este elemento.
Elementos del grupo 6
,
Un elemento del grupo 6 es un elemento situado dentro de la tabla periódica en el grupo 6 que comprende los elementos:
| Grupo | 6 |
| Periodo | |
| 4 | 24 Cr |
| 5 | 42 Mo |
| 6 | 74 W |
| 7 | 106 Sg |
"Grupo 6" es el actual nombre recomendado por la IUPAC. Antes se empleaba "grupo VIA" en el sistema europeo y "grupo VIB" en el estadounidense.
Elementos del grupo 7
El grupo 7 de la tabla periódica lo comprenden los elementos manganeso (Mn), tecnecio (Tc) y renio (Re), así como el elemento de número atómico 107, y su valencia son 3,4,6,7 con el nombre sistemático de unnilseptio (Uns); aunque éste no se suele considerar al referirse al grupo 7. "Grupo 7" es el nombre recomendado por la IUPAC; el antiguo nombre europeo es "grupo VIIA", mientras que el nombre antiguo estadounidense es "grupo VIIB". El nombre de la IUPAC no debe confundirse con los antiguos, dados con números romanos.
El manganeso es un metal con forma de un bloque de césped muy común en la naturaleza, mientras los otros elementos son muy raros. El tecnecio no tiene isótopos estables y durante mucho tiempo se creyó que no se encontraba en la naturaleza. El renio se encuentra tan sólo en trazas.
Elementos del grupo 8
Un elemento del grupo 8 es un elemento situado dentro de la tabla periódica en el grupo 8 que comprende los elementos:
| Grupo | 8 |
| Periodo | |
| 4 | 26 Fe |
| 5 | 44 Ru |
| 6 | 76 Os |
| 7 | 108 Hs |
En los niveles electrónicos externos de estos elementos hay 8 electrones, aunque el hierro no alcanza el estado de oxidación +8. El hassio se produce sólo en el laboratorio, no se encuentra en la naturaleza, y al referirse al grupo 8 se suele obviar este elemento.
"Grupo 8" es el actual nombre recomendado por la IUPAC. El antiguo sistema europeo y el estadounidense englobaban dentro del "grupo VIII" (o VIIIA el europeo y VIIIB el estadounidense) a los actuales grupos 8, 9 y 10.
Elementos del grupo 9
Los elementos del grupo 9 son:
| Código color en tabla: | Metales de transición |
A temperatura ambiente todos son sólidos. Los señalados en rojo son sintéticos y no están en la naturaleza.
Elementos del grupo 10
Los elementos del grupo 10 son:
| Grupo | 10 |
| Periodo | |
| 4 | 27 Ni |
| 5 | 45 Pd |
| 6 | 77 Pt |
| 7 | 110 Ds |
- Níquel (28)
- Paladio (46)
- Platino (78)
- Darmstadtio (110)
| código color en tabla: | metales de transición |
A temperatura ambiente todos son sólidos.
Propiedades comunes
Los estados de oxidación más comunes de los elementos de este grupo son 0 y +II. Todos se encuentran en la naturaleza en forma elemental aunque el níquel como el más reactivo de ellos, sólo en forma de aleación en algunos meteoritos.
Todos estos elementos tienen completados los números"d" de su capa de valencia lo que explica su relativa inercia frente a los agentes oxidantes que se hace más patente bajando en el grupo. Todos son metales importantes en ingeniería aeroespacial y en la industria química dada sus propiedades catalíticas.
Elementos del grupo 11
Los tres metales son denominados "metales de acuñar", aunque no es un nombre recomendado por la IUPAC.
Son relativamente inertes y difíciles de corroer. De hecho los tres existen en forma de elemento en la corteza terrestre y no se disuelven en ácidos no oxidantes y en ausencia de oxígeno.
El cobre también se emplea ampliamente en cables eléctricos y en electrónica. A veces se emplean contactos de oro en equipos de precisión. En ocasiones también se emplea la plata en estas aplicaciones, y también en fotografía, agricultura (sobre todo el cobre en formulaciones de fungicidas), medicamentos, equipos de sonido y aplicaciones científicas.
Estos metales son bastante blandos y no soportan bien el uso diario de las monedas, desgastándose con el tiempo. Por esto deben ser aleados con otros metales para conseguir monedas más duraderas, más duras y más resistentes al desgaste.
Elementos del grupo 12
El grupo 12, según la numeración recomendada por la IUPAC,1 es un grupo de elementos químicos de la tabla periódica que incluye el zinc (Zn), el cadmio (Cd) y el mercurio (Hg).2 Varios experimentos sobre átomos individuales de copernicio (Cn)3 apoyan la inclusión de este elemento también en el grupo 12. Según el sistema de numeración antiguo, tanto de la IUPAC como del CAS, este grupo se conocía como IIB.
Tanto el zinc como el cadmio y el mercurio están presentes en la naturaleza y tienen amplia aplicación en los ámbitos de la electricidad y la electrónica, así como para la formación de aleaciones. Los dos primeros miembros del grupo, en sus formas de metales sólidos poseen propiedades similares, mientras estén bajo condiciones normales. El mercurio, por su parte, es el único metal líquido a temperatura ambiente. Mientras que el zinc tiene gran importancia en la bioquímica de los seres vivos, el cadmio y el mercurio son altamente tóxicos. En cuanto al copernicio, dado que no existe de forma natural, debe ser sintetizado en el laboratorio.
Propiedades físicas
Como en otros grupos de la tabla periódica, los elementos del grupo 12 muestran patrones en su configuración electrónica, especialmente en la capa de valencia, lo que origina ciertas tendencias en su comportamiento químico:
| Z | Elemento | N.º de electrones por capa |
|---|---|---|
| 30 | zinc | 2, 8, 18, 2 |
| 48 | cadmio | 2, 8, 18, 18, 2 |
| 80 | mercurio | 2, 8, 18, 32, 18, 2 |
| 112 | copernicio | 2, 8, 18, 32, 32, 18, 2 (predicción) |
Los elementos del grupo 12 son metales blandos, diamagnéticos y divalentes, con los puntos de fusión más bajos de todos los metales de transición. El cinc es brillante y de color blanco azulado,4 aunque las calidades comerciales más comunes tienen un acabado mate.5 El cadmio es blando, dúctil, maleable y de color blanco azulado. El mercurio es un metal líquido, denso y plateado, el único metal líquido a temperatura ambiente; es un pobre conductor térmico pero un buen conductor de electricidad.6
En la tabla siguiente se resumen las principales propiedades físicas de los elementos del grupo 12. Se sabe muy poco del copernicio y ninguna de sus propiedades físicas se ha confirmado excepto su punto de ebullición —provisionalmente—.7
| Nombre | zinc | Cadmio | Mercurio | Copernicio |
|---|---|---|---|---|
| Punto de fusión | 693 K (420 °C) | 594 K (321 °C) | 234 K (−39 °C) | ? |
| Punto de ebullición | 1180 K (907 °C) | 1040 K (767 °C) | 630 K (357 °C) | 357+112 −108 K (84+112 −108 °C) |
| Densidad | 7,14 g cm−3 | 8,65 g cm−3 | 13,534 g cm−3 | 23,7 g cm−3 (?) |
| Apariencia | blanco azulado metálico | blanco azulado | plateado | ? |
| Radio atómico | 135 pm | 155 pm | 150 pm | 147 pm (?) |
El cinc es algo menos denso que el hierro y posee una estructura cristalina hexagonal.8 Es un metal duro y frágil, pero se vuelve maleable entre 100 y 150 °C.45 Por encima de los 220 °C, el metal se vuelve de nuevo frágil y puede ser pulverizado por golpeo.9 El cinc es un conductor eléctrico aceptable4 y, para tratarse de un metal, tiene puntos de fusión y ebullición relativamente bajos. El cadmio es similar al cinc en muchos aspectos, pero forma complejos de coordinación.10 Al contrario que otros metales, el cadmio es resistente a la corrosión, por lo que puede utilizarse como capa protectora revistiendo otros metales. El cadmio es, en general, insoluble en agua y no inflamable; sin embargo, cuando se encuentra finamente dividido puede arder y liberar vapores tóxicos.11 Por su parte, el mercurio tiene una temperatura de fusión extraordinariamente baja para tratarse de un metal del bloque d.
Cinc, cadmio y mercurio forman un amplio abanico de aleaciones. El latón, por ejemplo, es una aleación de cinc y cobre, y también forman aleaciones binarias con el cinc el aluminio, el antimonio, el bismuto, el oro, el hierro, el plomo, el mercurio, la plata, el estaño, el magnesio, el cobalto, el níquel, el telurio y el sodio.12 Aunque ni el cinc ni el circonio son ferromagnéticos, su aleación ZrZn2 muestra ferromagnetismo por debajo de los 35 K.4 El cadmio se utiliza en muchos tipos de aleaciones de soldadura y cojinete, gracias a su bajo coeficiente de fricción y su resistencia a la fatiga.13 También se encuentra en algunas de las aleaciones con puntos de fusión más bajos, como el metal de Wood.14 Al ser líquido, el mercurio disuelve a otros metales y las aleaciones que forma se denominan amalgamas. Se conocen amalgamas con oro, cinc, sodio y muchos otros metales. El hierro es una excepción, por lo que tradicionalmente se han utilizado recipientes de este metal para almacenar el mercurio. Otros metales que no se amalgaman con el mercurio son el tantalio, el wolframio y el platino. La amalgama de sodio es un agente reductor muy común en síntesis orgánica y también se utiliza en las lámparas de vapor de sodio a alta presión. El mercurio también se combina fácilmente con aluminio para formar una amalgama de aluminio cuando ambos metales puros entran en contacto. Dado que la amalgama reacciona con el aire para dar óxido de aluminio, pequeñas cantidades de mercurio pueden corroer el aluminio. Es por ello que, generalmente, no se permite introducir mercurio en una aeronave, debido al riesgo de que se amalgame con partes de aluminio que puedan estar al descubierto.15
Propiedades químicas
Solo se ha estudiado la química de los tres primeros miembros del grupo 12. La química del copernicio aún no está bien establecida; por lo tanto, en esta sección se hablará únicamente del cinc, el cadmio y el mercurio.
Tendencias periódicas
Todos los elementos del grupo 12 son metálicos. La similitud de los radios metálicos del cadmio y el mercurio es fruto de la contracción lantánida; así pues, la tendencia en el grupo 12 es diferente a la del grupo 2, los metales alcalinotérreos, en donde el radio metálico aumenta paulatinamente al descender en el grupo. Los tres metales tienen puntos de fusión y ebullición relativamente bajos, lo que indica que el enlace metálico es más o menos débil, con un solapamiento relativamente pequeño entre la banda de valencia y la banda de conducción.16 Por ello, el cinc está cerca de la frontera entre metales y semimetales, que normalmente se sitúa entre el galio y el germanio, si bien el galio toma parte en semiconductores como el arseniuro de galio.
El cinc y el cadmio son electropositivos, mientras que el mercurio no lo es.16 Como consecuencia, ambos son buenos agentes reductores. Los elementos del grupo 12 poseen un estado de oxidación +2 en el que los iones tienen una configuración electrónica d10 relativamente estable, con una subcapa completa. Sin embargo, el mercurio puede reducirse fácilmente al estado de oxidación +1; normalmente, dos iones de mercurio(I) se combinan en la especie diamagnética Hg2+
2 formando un enlace metal-metal.17 El cadmio también puede formar especies como [Cd2Cl6]4− en que el estado de oxidación del metal es +1. Como en el caso del mercurio, la formación de un enlace metal-metal resulta en una especie diamagnética sin electrones desapareados, lo que la hace muy reactiva. El cinc(I) solo se conoce en fase gas en compuestos como el Zn2Cl2, lineal, análogo al calomelano.
2 formando un enlace metal-metal.17 El cadmio también puede formar especies como [Cd2Cl6]4− en que el estado de oxidación del metal es +1. Como en el caso del mercurio, la formación de un enlace metal-metal resulta en una especie diamagnética sin electrones desapareados, lo que la hace muy reactiva. El cinc(I) solo se conoce en fase gas en compuestos como el Zn2Cl2, lineal, análogo al calomelano.
Clasificación
Los elementos del grupo 12 suelen considerarse elementos del bloque d pero no elementos de transición, ya que su capa d está completa. Algunos autores clasifican estos elementos como representativos, al tener sus electrones de valencia en los orbitales ns2. Sin embargo, comparten muchas características con los vecinos elementos del grupo 11, que son considerados metales de transición casi universalmente. Por ejemplo, el cinc tiene muchas características en común con el metal de transición adyacente, el cobre. Los complejos de cinc se incluyen en la serie de Irving–Williams, pues muchos mantienen la misma estequiometría que los complejos de cobre(II), si bien con menores constantes de estabilidad.18 Hay poca similitud entre el cadmio y la plata, siendo infrecuentes los compuestos de plata(II) —aquellos que sí existen son agentes oxidantes muy fuertes—. Del mismo modo, el hecho de que el estado de oxidación más frecuente para el oro sea +3 impide una gran similitud entre la química del oro y la del mercurio, si bien sí hay parecidos entre el mercurio(I) y el oro(I) tales como la formación de complejos lineales diciano, [M(CN)2]−. Si se atiende a la definición de metal de transición según la IUPAC, «elemento cuyo átomo tiene una subcapa d incompleta o puede dar lugar a cationes con una subcapa d incompleta»,19 el cinc y el cadmio no son elementos de transición, mientras que el mercurio sí: solo al mercurio se le conoce un compuesto en el que su estado de oxidación sea mayor que +2, el fluoruro de mercurio(IV).20 No obstante, esta clasificación se basaría en un compuesto extremadamente atípico que no ha sido observado en condiciones de equilibrio y contradiría la química más típica del mercurio, así que se ha sugerido que sería mejor no considerar el mercurio como un metal de transición.21
Relación con los metales alcalinotérreos
Aunque el grupo 12 cae dentro del bloque d en la tabla de dieciocho columnas moderna, los electrones d del cinc, del cadmio y —casi siempre— del mercurio se comportan como electrones internos y no toman parte en el enlace. Este comportamiento concuerda con el de los elementos representativos, pero contrasta notablemente con el de los elementos del grupo 11 —cobre, plata y oro—, que también tienen las subcapas d completas en el estado fundamental pero se comportan químicamente como metales de transición. Por ejemplo, los enlaces del sulfuro de cromo(II) (CrS) involucran principalmente los electrones 3d, los del sulfuro de hierro(II) (FeS) involucran tanto los electrones 3d como los 4s, pero los del sulfuro de cinc (ZnS) involucran únicamente los electrones 4s, comportándose los electrones 3dcomo electrones internos.
Puede, pues, hacerse una comparación útil entre las propiedades de los elementos del grupo 12 y las de los dos primeros metales alcalinotérreos, el berilio y el magnesio. Por ejemplo, el cinc y el cadmio se parecen al berilio y al magnesio en sus radios atómicos, radios iónicos, electronegatividades y, también, en la estructura de sus compuestos binarios y su habilidad para formar iones complejos con ligandos nitrogenados y oxigenados, como aminas e hidruros complejos. Sin embargo, el berilio y el magnesio son átomos pequeños, al contrario que los alcalinotérreos más pesados y al igual que los elementos del grupo 12 —que tienen una mayor carga nuclear pero el mismo número de electrones de valencia—, y las tendencias periódicas al descender por el grupo 2 desde el berilio hasta el radio son menos paulatinas al descender desde el berilio hacia el mercurio, debido a las contracciones escándida y lantánida. Son ambas contracciones las que aportan al mercurio muchas de sus propiedades características.21
| Nombre | Berilio | Magnesio | Calcio | Estroncio | Bario | Radio |
|---|---|---|---|---|---|---|
| Config. electrones de valencia | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 |
| Config. electrones internos | [He] | [Ne] | [Ar] | [Kr] | [Xe] | [Rn] |
| Estados de oxidaciónnota 1 | +2, +1 | +2, +1 | +2, +1 | +2, +1 | +2 | +2 |
| Punto de fusión | 1560 K (1287 °C) | 923 K (650 °C) | 1115 K (842 °C) | 1050 K (777 °C) | 1000 K (727 °C) | 973 K (700 °C) |
| Punto de ebullición | 2742 K (2469 °C) | 1363 K (1090 °C) | 1757 K (1484 °C) | 1655 K (1382 °C) | 2170 K (1897 °C) | 2010 K (1737 °C) |
| Apariencia | metálico grisáceo | gris metálico | plateado mate | blanco plateado | gris plateado | blanco plateado |
| Densidad | 1,85 g cm−3 | 1,738 g cm−3 | 1,55 g cm−3 | 2,64 g cm−3 | 3,51 g cm−3 | 5,5 g cm−3 |
| Electronegatividad de Pauling | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
| Radio atómico | 105 pm | 150 pm | 180 pm | 200 pm | 215 pm | 215 pm |
| Radio iónico | 59 pm | 86 pm | 114 pm | 132 pm | 149 pm | 162 pm |
| Color de la llama | blanca21 | blanca brillante22 | rojo ladrillo22 | carmesí22 | verde manzana22 | carmesínota 2 |
| Química organometálica | amplia | amplia | pobre | muy pobre | muy pobre | extremadamente pobre |
| Hidróxido | anfótero | básico | básico | fuertemente básico | fuertemente básico | fuertemente básico |
| Óxido | anfótero | fuertemente básico | fuertemente básico | fuertemente básico | fuertemente básico | fuertemente básico |
| Nombre | Berilio | Magnesio | Cinc | Cadmio | Mercurio | Copernicio |
| Config. electrones de valencia | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 (?) |
| Config. electrones internos | [He] | [Ne] | [Ar]3d10 | [Kr]4d10 | [Xe]4f145d10 | [Rn]5f146d10 (?) |
| Estados de oxidaciónnota 1 | +2, +1 | +2, +1 | +2, +1 | +2, +1 | +4, +2, +1 | +4, +2, +1, 0(?)242526 |
| Punto de fusión | 1560 K (1287 °C) | 923 K (650 °C) | 693 K (420 °C) | 594 K (321 °C) | 234 K (−39 °C) | ? |
| Punto de ebullición | 2742 K (2469 °C) | 1363 K (1090 °C) | 1180 K (907 °C) | 1040 K (767 °C) | 630 K (357 °C) | 357+112 −108 K (84+112 −108 °C) |
| Apariencia | metálico grisáceo | gris metálico | gris azulado metálico | gris plateado | plateado | ? |
| Densidad | 1,85 g cm−3 | 1,738 g cm−3 | 7,14 g cm−3 | 8,65 g cm−3 | 13,534 g cm−3 | 23,7 g cm−3 (?)25 |
| Electronegatividad de Pauling | 1,57 | 1,31 | 1,65 | 1,69 | 2,00 | ? |
| Radio atómico | 105 pm | 150 pm | 135 pm | 155 pm | 150 pm | 147 pm (?)25 |
| Radio iónico | 59 pm | 86 pm | 88 pm | 109 pm | 116 pm | 75 pm (?)25 |
| Color de la llama | blanca | blanca brillante | verde azuladanota 3 | ? | ? | ? |
| Química organometálica | amplia | amplia | amplia | amplia | amplia | ? |
| Hidróxido | anfótero | básico | anfótero | débilmente básico | ? | ? |
| Óxido | anfótero | fuertemente básico | anfótero | moderadamente básico | moderadamente básico | ? |
Compuestos
Véanse también: Compuestos de cinc, Compuesto de organocinc, Compuestos de mercurio y Organomercurio.
Los tres iones metálicos forman numerosas especies tetraédricas, como MCl2−
4. Tanto el cinc como el cadmio pueden formar también complejos octaédricos como los iones acuo [M(H2O)6]2+, presentes en las disoluciones acuosas de sales de estos metales.27 El carácter covalente se consigue usando los orbitales s y, posiblemente, los p. El mercurio, no obstante, raramente excede un número de coordinaciónde cuatro. También se conocen números de coordinación de 2, 3, 5, 7 y 8.
4. Tanto el cinc como el cadmio pueden formar también complejos octaédricos como los iones acuo [M(H2O)6]2+, presentes en las disoluciones acuosas de sales de estos metales.27 El carácter covalente se consigue usando los orbitales s y, posiblemente, los p. El mercurio, no obstante, raramente excede un número de coordinaciónde cuatro. También se conocen números de coordinación de 2, 3, 5, 7 y 8.
Extensiones
El elemento más pesado conocido del grupo 12 es el copernicio, pero existen teorías acerca de posibles elementos más pesados dentro del grupo. Aunque una simple extrapolación de la estructura de la tabla periódica colocaría debajo del copernicio al elemento 162, el unhexbio (Uhb), los cálculos relativistas de Dirac–Fock predicen que el siguiente elemento del grupo 12 sería en realidad el 164, el unhexcuadio (Uhq), cuya configuración electrónica prevista es [Uuo] 5g18 6f14 7d10 8s2 8p½2.2528 Los orbitales 8s y 8p½ serían, según las predicciones, tan estables debido a efectos relativistas que sus electrones se comportarían como electrones internos y no participarían en las reacciones, al contrario que en los anteriores elementos del grupo 12, donde los electrones s se comportan como electrones de valencia. No obstante, sí se espera que los niveles 9s y 9p½ puedan enlazar e hibridarse, por lo que el unhexcuadio todavía debería comportarse químicamente como un metal de transición normal. Los cálculos predicen que los electrones 7d del unhexcuadio deberían tomar parte con facilidad en las reacciones químicas, así que, además del usual estado de oxidación +2, este elemento debería mostrar estados +4 y +6 en disolución acuosa con ligandos fuertes. El unhexcuadio podría, pues, formar compuestos como el Uhq(CO)4, el Uhq(PF3)4 —ambos tetraédricos— o el Uhq(CN)2−
2 —lineal—, lo que constituye un comportamiento muy distinto al del plomo, del que sería homólogo si no fuese por los efectos relativistas. No obstante, en disolución acuosa prevalecería la especie divalente, y el unhexcuadio(II) debería comportarse de forma más parecida al plomo que el unhexcuadio(IV) o el unhexcuadio(VI).2526
2 —lineal—, lo que constituye un comportamiento muy distinto al del plomo, del que sería homólogo si no fuese por los efectos relativistas. No obstante, en disolución acuosa prevalecería la especie divalente, y el unhexcuadio(II) debería comportarse de forma más parecida al plomo que el unhexcuadio(IV) o el unhexcuadio(VI).2526
El unhexcuadio debería ser, como el mercurio, un metal blando. Las predicciones muestran que el unhexcuadio metálico formaría enlaces covalentes metal-metal, por lo que tendría un alto punto de fusión. Además, se espera que sea un ácido de Lewis blando, con un factor de Ahrlands cercano a los 4 eV. El unhexcuadio debería tener propiedades en común con el ununoctio y con los otros elementos del grupo 1225 y tendría, como mucho, una reactividad moderada, con un primer potencial de ionización de alrededor de 685 kJ mol−1, del orden del molibdeno.2629 Debido a las contracciones lantánida, actínida y superactínida, el unhexcuadio tendría un radio metálico de tan solo 158 pm, cercano al del magnesio, si bien con una masa atómica unas 19,5 veces mayor, de en torno a 474 Da.29 Debido a su pequeño tamaño y gran masa, se espera que tenga una altísima densidad de en torno a 46 g cm−3, más que duplicando la del osmio, el elemento más denso conocido, con 22,61 g cm−3. El unhexcuadio sería, pues, el segundo elemento más denso de los nueve primeros períodos de la tabla periódica, tan solo superado por su vecino, el unhextrio (Uht, Z = 163), con 47 g cm−3.29 El unhexcuadio metálico debería ser relativamente estable, pues los electrones 8s y 8p½ se encuentran en capas muy profundas y solo los electrones 7d pueden enlazar; además, la energía de cohesión debería ser alta gracias a los enlaces covalentes, lo que muy probablemente resultaría en un alto punto de fusión.26
El interés teórico en la química del unhexcuadio está motivado, principalmente, por las predicciones que indican que su isótopo 482Uhq —con 164 protones y 318 neutrones— estaría en el centro de una hipotética segunda isla de estabilidad. La primera estaría centrada en el 306Ubb, con 122 protones y 184 neutrones.303132
Historia
Los elementos del grupo 12 han ido siendo descubiertos a lo largo de toda la Historia, bien utilizados desde tiempos antiguos, bien descubiertos en laboratorios. El grupo en sí no posee un nombre trivial, pero en el pasado se lo denominaba grupo IIB.
Cinc
Se han detectado usos del cinc en formas impuras desde la Antigüedad, así como en aleaciones —como el latón— de más de dos mil años de edad.3334 El cinc ya se conocía como metal, bajo el nombre jasada (जसद), en el manual médico atribuido al rey hindú Madanapāla y escrito en torno a 1374.35 También era empleado por los alquimistas.36 El nombre del metal se documenta por primera vez en el siglo xvi,37 y deriva probablemente de la palabra alemana Zinke, «púa», debido a la forma de aguja de los cristales metálicos.38
El aislamiento del cinc metálico en el mundo occidental puede ser adjudicado, de modo independiente, a varias personas durante el siglo xvii.39 Normalmente se reconoce al químico alemán Andreas Marggraf el mérito de descubrir el cinc metálico, en un experimento de 1746 en el que calentaba una mezcla de calamina y carbón en un recipiente cerrado sin cobre, obteniéndose un metal.40 El italiano Luigi Galvani abrió un camino, gracias a sus experimentos con latón en ranas en 1780, para el descubrimiento de la pila eléctrica, la galvanización y la protección catódica.4142 En el mismo año un amigo de Galvani, Alessandro Volta, inventó la pila voltaica.41 Sin embargo, la importancia del cinc en el ámbito biológico no se descubrió hasta 1940, cuando se demostró que la anhidrasa carbónica, una enzima que elimina el dióxido de carbono de la sangre, poseía un átomo de cinc en su sitio activo.43
Cadmio
El cadmio fue descubierto en Alemania en 1817 por Friedrich Stromeyer y Karl Samuel Leberecht Hermann, como impureza en minerales de carbonato de cinc —calamina—.44 Su nombre viene, precisamente, de la palabra latina para designar la calamina, cadmia, procedente a su vez del nombre en griego de Cadmo, «Κάδμος», fundador de Tebas e introductor en Grecia de la tecnología de la fundición, según la mitología.45
En el año 1927, la Oficina Internacional de Pesas y Medidas redefinió el metro en función de la línea espectral roja del cadmio, asignándolo a 1 553 164,13 longitudes de onda.46 Esta definición ha cambiado con el tiempo; la actual hace referencia a la velocidad de la luz en el vacío.47
Mercurio
El mercurio ya se empleaba en la cosmética egipcia, tal y como atestiguan los restos encontrados en tumbas egipcias del año 1500 a. C.,48 así como en la antigua China, en la creencia de que el mercurio mejoraba la salud y alargaba la vida.49 En torno a 500 a. C. ya se empleaba para fabricar amalgamas.50 En la época de la alquimia el mercurio era considerado la prima materia, el material de partida de los procesos alquímicos, a partir de la cual derivaban todos los metales. Se creía que los diferentes metales podían obtenerse sencillamente variando la cantidad y calidad de azufre contenido en el mercurio. El más puro de todos ellos era el oro, y se consideraba que el mercurio jugaba un papel primordial en la transmutación de metales base —metales «impuros»— en oro, lo que constituía el objetivo final de la alquimia.51
El símbolo químico moderno del mercurio es Hg. Este símbolo procede del nombre latino del metal, hydrargyrus, que es a su vez una versión latinizada del nombre griego ὑδράργυρος, «hydrárgyros». Su significado era «agua de plata», debido a su apariencia, y de esta palabra procede el otro nombre español del metal, hidrargiro o hidrargirio. El nombre «mercurio» se tomó del dios romano Mercurio, con quien se asociaban las virtudes de la velocidad y la movilidad. Se lo relaciona también con el planeta Mercurio; de hecho, el símbolo astrológico de Mercurio, «☿», es también el símbolo alquímico tradicional del metal.52 Además, el mercurio es el único metal cuyo nombre alquímico planetario ha acabado por convertirse en el nombre común del elemento.51
Copernicio
El elemento más pesado conocido del grupo 12, el copernicio, fue creado por primera vez el 9 de febrero de 1996 en la Gesellschaft für Schwerionenforschung (GSI) de Darmstadt (Alemania) por Sigurd Hofmann, Victor Ninov et al.53 El 19 de febrero de 2010, aniversario del nacimiento de Nicolás Copérnico, la IUPAC le otorgó el nombre oficial «copernicio», sustituyendo al nombre provisional «unumbio».54
Abundancia
Como sucede en la mayor parte de los grupos del bloque d, la abundancia de los elementos del grupo 12 en la corteza terrestre disminuye al aumentar el número atómico. El cinc es, con 65 ppm, el elemento más abundante del grupo, mientras que el cadmio, con 0,1 ppm, y el mercurio, con 0,04 ppm, son varios órdenes de magnitud menos abundantes.55 En cuanto al copernicio, al tratarse de un elemento sintético con una semivida de pocos minutos, solo se encuentra en los laboratorios donde se produce.
Los metales del grupo 12 son calcófilos: tienen una baja afinidad por el oxígeno, prefiriendo formar sulfuros. Las menas de estos metales se formaron durante la solidificación de la corteza de la Tierra primigenia, bajo las condiciones reductoras de la atmósfera entonces existente.56 Dichas menas son, pues, eminentemente sulfuros.16 La mena de cinc más aprovechada comercialmente es la blenda, una forma de sulfuro de cinc (ZnS) cuyo contenido en este metal oscila entre el 60 % y el 62 %.8 En cambio, no se conocen depósitos significativos de minerales de cadmio. El único que reviste cierta importancia es la greenockita (CdS), pero esta se encuentra asociada casi siempre a la blenda debido a la similitud química entre el cinc y el cadmio, similitud que hace, además, difícil su separación geológica. Consecuentemente, el cadmio suele obtenerse como producto secundario del tratamiento de menas de cinc y, en menor medida, plomo y cobre.5758 El mercurio, por su parte, es un elemento especialmente raro en la corteza terrestre, pues no se combina geoquímicamente con los elementos más comunes. Aunque puede encontrarse nativo, suele aparecer en minerales como el cinabrio, la corderoíta o la livingstonita.59
Las reservas mundiales de cinc se han estimado en 1900 millones de toneladas,60 localizándose los depósitos principales en Australia, Canadá y los Estados Unidos.56 Hasta 2002, se habían extraído alrededor de 346 millones de toneladas de cinc a lo largo de la historia, y se estima que siguen actualmente en uso más de 100 millones de toneladas de ese material.61 Diversos estudios sugieren que, al ritmo actual de consumo, el agotamiento de las reservas se produciría entre los años 2027 y 2055.6263 En cuanto al mercurio, su primera productora mundial es China, que controla casi dos terceras partes del comercio mundial, seguida por México.64
Producción
El cinc, con una producción anual de alrededor de 13 millones de toneladas, es el cuarto metal más usado, únicamente por detrás del hierro, el aluminio y el cobre.65 El 95 % de este metal se extrae de depósitos de sulfuros, donde la blenda está casi siempre mezclada con sulfuros de cobre, plomo y hierro. El cinc metálico se produce mediante técnicas de metalurgia extractiva.66 Un proceso de tostadoconvierte el sulfuro de cinc concentrado en óxido de cinc, a partir del cual puede obtenerse el metal mediante procesos pirometalúrgicos, o bien mediante extracción electrolítica.67 El procesado pirometalúrgico opera reduciendo el óxido de cinc con monóxido de carbono a 950 °C, obteniéndose el metal como vapor y condensándose este.68 Con el método electrolítico se lixivia la mena con ácido sulfúricopara, a continuación, obtener el metal mediante electrólisis.69
El cadmio es una impureza común en las menas de cinc, y normalmente se obtiene durante el procesado de este metal. Algunos concentrados de menas sulfúricas de cinc contienen hasta un 1,4 % de cadmio. El metal puede aislarse de los humos de proceso mediante destilación al vacío, o bien precipitando el sulfato de la disolución electrolítica.70
Las menas más ricas en mercurio pueden contener hasta un 2,5 % en masa de este metal, aunque incluso los depósitos menos concentrados contienen, como mínimo, un 0,1 %, siendo el cinabrio —sulfuro de mercurio, HgS— la mena más común.59 El mercurio se extrae de él calentando el mineral en una corriente de aire para, a continuación, condensar el vapor y recoger el metal.71
Por último, los elementos superpesados como el copernicio se producen bombardeando átomos de elementos más ligeros en aceleradores de partículas, dando como resultado reacciones de fusión nuclear. No obstante, aunque la mayoría de isótopos del copernicio pueden obtenerse directamente de este modo, los más pesados solo se han observado como productos del decaimiento radiactivo de otros elementos de mayor número atómico.72 La primera reacción de fusión que produjo copernicio se llevó a cabo en la GSI en el año 1996, según el siguiente esquema:53
En total, se han producido unos 75 átomos de copernicio a través de diversas reacciones nucleares.
Aplicaciones
Debido a sus similaridades físicas, los elementos del grupo 12 se encuentran en multitud de situaciones comunes. El cinc y el cadmio se utilizan habitualmente como agentes de galvanización contra la corrosión,2 pues tienden a atraer toda la oxidación de su medio hasta haberse corroído por completo.73 Esta cobertura protectora puede aplicarse sobre otros metales mediante galvanización térmica, sumergiendo el objeto en el metal fundido,74 o bien mediante galvanoplastia por medios electrolíticos, pudiendo añadírsele una pasivación con cromatos.75 Los elementos de este grupo también se usan en electroquímica como alternativa al electrodo estándar de hidrógeno, además de servir de electrodo de referencia secundario.76
En Estados Unidos, el zinc es usado predominantemente para el cincado (55%) y para latón, bronce y otras aleaciones (37%). 77 La reactividad relativa del zinc y su habilidad para oxidarse lo convierte en un eficiente ánodo de sacrificio en la protección catódica (CP). Por ejemplo, la protección catódica de una tubería enterrada se puede lograr conectando ánodos de zinc a la tubería.78 El zinc actúa como el ánodo (electrodo negativo) mientras se corroe lentamente al pasar la corriente eléctrica del zinc a la tubería.78nota 4 El zinc también se usa en la protección catódica de metales que están expuestos al agua marina para protegerlos de la corrosión.7980 El zinc también se usa como material en pilas, como en una pila de zinc-carbono8182 o en una pila de combustible/batería de cinc-aire.838485 Una aleación muy usada que contiene zinc es el latón.78 El latón tiene generalmente mayor ductilidad y dureza que el cobre y presenta mayor resistencia contra la corrosión.78 Estas propiedades lo hacen útil en equipamiento de comunicaciones, hardware, instrumentos musicales y válvulas de agua.78 Otras aleaciones de zinc usadas frecuentemente son la alpaca o el bronce comercial.4 Aleaciones formadas principalmente por zinc y pequeñas cantidades de cobre, aluminio y magnesio son útiles en fundición prensada y fundición centrifugada, especialmente en la industria automovilística, eléctrica y de hardware.4 Estas aleaciones se comercializan bajo el nombre de Zamak.86 Aproximadamente un cuarto de toda la producción de zinc, en los Estados Unidos (2009), se consume en forma de compuestos de zinc, de los cuales una parte es consumida industrialmente.77
Grupo del boro
El grupo del boro, boroides o boroideos es una serie de elementos que están situados en el grupo 13 de la tabla periódica de los elementos. Su nombre proviene de Tierra, ya que el aluminio es el elemento más abundante en ella, llegando a un 7.5%. Tienen tres electrones en su nivel energético más externo. Su configuración electrónica es ns2np1.
El primer elemento del grupo 13 es el boro(B) (aunque también se lo conoce como grupo del aluminio por su concurrido uso en la actualidad), un metaloide con un punto de fusión muy elevado y en el que predominan las propiedades no metálicas. Los otros elementos que comprenden este grupo son: aluminio(Al), galio (Ga), indio (In), talio(Tl), y Nihonio(Nh) que forman iones con una carga triple positiva (3+), salvo el talio que lo hace con una carga monopositiva (1+).
La característica del grupo es que los elementos tienen tres electrones en su capa más externa, por lo que suelen formar compuestos en los que presentan un estado de oxidación +3. El talio difiere de los demás en que también es importante su estado de oxidación +1. Esta baja reactividad del par de electrones es conforme se baja en el grupo se presenta también en otros grupos, se denomina efecto del par inerte y se explica considerando que al bajar en el grupo las energías medias de enlace van disminuyendo.
Propiedades Químicas
- Ninguno muestra tendencia a formar aniones simples.
- Tienen estado de oxidación +3, pero también +1 en varios elementos. Esto ocurre debido al "Efecto Par Inerte" según el cual, al perder primero un electrón del orbital np, el orbital ns queda lleno, lo que lo hace menos reactivo. Para Ga e In, el estado de oxidación +1 es menos importante que +3. Para Tl, los compuestos con Tl+ se asemejan a los compuestos con metales alcalinos.
- Como se ve, la molécula presenta un enlace de tres centros, no se puede distinguir cual enlace H-B-H se forma primero y su longitud es la misma.
- El Boro puede formar enlaces covalentes bien definidos, es un semiconductor, es duro a diferencia del resto que son muy blandos. El boro forma compuestos con hidrógeno llamados boranos, siendo el más simple el diborano B2H6.
Propiedades Físicas
- El boro se diferencia del resto de los elementos del grupo porque es un metaloide, mientras que los demás van aumentando su carácter metálico conforme se desciende en el grupo.
- Tienen puntos de fusión muy bajos, a excepción del boro.
- El boro es un metaloide con un punto de fusión muy alto y gran dureza en el que predominan las propiedades no metálicas. Los otros elementos que comprenden este grupo son metales y forman, como el boro, iones con una carga triple positiva (3+); presentan puntos de fusión notablemente más bajos que el boro —destacando el galio que funde a tan sólo 29ºC— y son blandos y maleables.
Reacciones
- No reaccionan con agua, excepto el aluminio, que reacciona en su superficie formando una órbita electrónica que impide que continúe la reacción.
-
- 2Al(s) + 3 H2O —> Al2O3(s) + 3H2(g).

Carbonoideos
El grupo 14 de la tabla periódica de los elementos (antiguo grupo IV A), también conocido como grupo del carbono o de los carbonoideos, está formado por los siguientes elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb), flerovio (Fl).
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el carbono, elemento fundamental de la química orgánica. A su vez, el silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran importancia en la sociedad a partir del siglo XX, ya que es el elemento principal de los circuitos integrados.
Al bajar en el periodo, estos elementos van teniendo características cada vez más metálicas: el carbono es un no metal, el silicio y el germanio son semimetales, y el estaño, el plomo y el flerovio son metales.




























Comentarios
Publicar un comentario